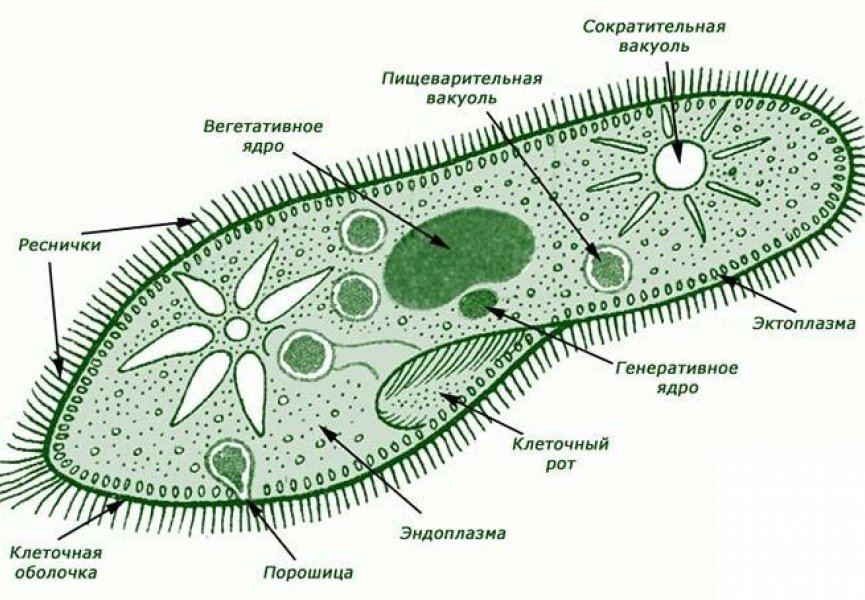
Раковины одноклеточных являются важной частью их защитной оболочки. Они образованы из различных материалов, включая карбонаты, кремний и белки. Каждый вид одноклеточных имеет свою уникальную структуру раковины, что делает их особенно интересными для исследования.
Далее в статье мы рассмотрим различные типы материалов, из которых образуются раковины одноклеточных. Мы также поговорим о процессе образования и функциях раковины, а также о том, какие факторы могут влиять на ее структуру. В конце статьи мы рассмотрим значимость изучения раковин одноклеточных для понимания эволюции и адаптации организмов к окружающей среде.
Состав раковин одноклеточных
Раковины одноклеточных организмов являются замечательными структурами, которые выполняют ряд функций, таких как защита, поддержка и регуляция внутренней среды. Состав раковин варьирует в зависимости от вида организма, однако обычно они состоят из неорганических и органических веществ.
Неорганический состав
Неорганический состав раковин одноклеточных обычно включает в себя минеральные вещества, такие как кальций и кремний. Кальций является наиболее распространенным компонентом раковин и образует кристаллическую структуру, которая придает им прочность и жесткость. Кремний также может быть включен в состав раковин и играет важную роль в формировании и поддержании их структуры.
Органический состав
Органический состав раковин одноклеточных включает в себя различные органические молекулы, такие как белки, липиды и углеводы. Белки служат основным компонентом раковин и обеспечивают их прочность и эластичность. Липиды могут быть также присутствовать в раковинах и выполнять роль защитного слоя. Углеводы могут играть роль в формировании структуры раковины и предоставлять дополнительную прочность.
Важность раковин одноклеточных
Состав раковин одноклеточных является ключевым фактором, определяющим их функциональные свойства и адаптивные возможности. Раковины обеспечивают защиту от внешней среды, предотвращают повреждения клеток и играют роль в поддержании структуры организма. Кроме того, раковины могут служить для регуляции внутренней среды, участвуя в процессах обмена веществ и регуляции pH.
Строение Одноклеточных Водорослей на примере Хламидомонады / Биология онлайн с Александрой Соболевой
Кальций
Кальций – это химический элемент, принадлежащий к группе щелочноземельных металлов. Он является одним из самых распространенных элементов на Земле и имеет атомный номер 20 в таблице Менделеева. Кальций является важным элементом для жизни и широко распространен в природе.
Кальций имеет множество функций в организмах различных организмов. Он является основным строительным компонентом костей и зубов и играет важную роль в поддержании их здоровья и прочности. Кроме того, кальций участвует в множестве биологических процессов, таких как сокращение мышц, передача нервных импульсов и свертываемость крови.
Кальций в раковинах одноклеточных
Кальций также является важным компонентом раковин многих одноклеточных организмов, таких как диатомовые водоросли и фораминиферы. Раковины этих организмов состоят из кальция карбоната, который выпадает в виде кристаллов и формирует структуру раковины.
Процесс образования раковин начинается с извлечения ионов кальция из окружающей среды организмом. Затем эти ионы кальция соединяются с углекислым гидратом, образуя кристаллы кальция карбоната. Эти кристаллы служат строительным материалом для формирования раковины. Форма и структура раковины зависят от специфических характеристик организма и его окружающей среды.
Интересно отметить, что эволюция и разнообразие раковин одноклеточных организмов, образованных с использованием кальция, имеет важное значение в палеонтологии и изучении истории жизни на Земле. Изучение структуры и состава раковин позволяет ученым сделать выводы о прошлых климатических условиях и окружающей среде, а также о процессах эволюции и экологии этих организмов.
Кремний
Кремний (Si) — химический элемент из группы углеродсодержащих неметаллов, который широко распространен в земной коре. Он является вторым по распространенности элементом после кислорода и составляет около 28% массы земной коры.
Кремний имеет атомный номер 14 и химический символ Si. Он обладает положительными и отрицательными электронными зарядами, что делает его полупроводником. Из-за своих полупроводниковых свойств, кремний широко применяется в электронике и солнечных батареях.
Физические и химические свойства кремния:
- Кремний является твердым веществом с серовато-серебристым оттенком.
- Он обладает высокой температурой плавления и кипения.
- Кремний хорошо проводит тепло и электричество.
- Он является химически инертным элементом и не реагирует с большинством кислот и щелочей.
- Кремний образует многочисленные соединения, включая оксиды, силикаты и кремнийорганические соединения.
Применение кремния:
Кремний имеет широкое применение в различных отраслях:
- Электроника: кремниевые чипы и полупроводники используются в производстве компьютеров, мобильных устройств, телевизоров и других электронных устройств.
- Солнечные батареи: кремний используется для производства солнечных панелей, которые преобразуют солнечный свет в электрическую энергию.
- Строительство: кремнийорганические соединения используются в производстве гидрофобизаторов для защиты строительных материалов от воздействия влаги и плесени.
- Стекло и керамика: кремний является основным компонентом стекла и керамических изделий.
- Металлургия: кремний добавляется в сталь для улучшения ее прочности и устойчивости к коррозии.
Кремний является одним из самых важных элементов в современной технологии и играет важную роль в различных отраслях промышленности и науки.

Магний
Магний (Mg) – это химический элемент, принадлежащий к группе щелочноземельных металлов. Он обладает атомным номером 12 и является одним из самых распространенных элементов на Земле. Магний имеет серебристо-серый цвет и относительно низкую плотность, что делает его легким металлом.
Физические свойства магния:
- Атомный номер: 12
- Атомная масса: 24,305 г/моль
- Температура плавления: 650 °C
- Температура кипения: 1090 °C
- Плотность: 1,738 г/см³
- Твердотельная структура: гексагональная ближнего упорядочения
Химические свойства магния:
- Магний обладает высокой химической реактивностью, особенно при взаимодействии с кислородом. Это свойство приводит к образованию оксидов магния, таких как магния оксид (MgO), который широко используется в промышленности.
- Магний является хорошим проводником электричества и тепла.
- Он обладает низкой плотностью и высокой прочностью, что делает его идеальным материалом для создания легких конструкций, таких как автомобили и самолеты.
- Магний также используется в производстве сплавов, таких как алюминиево-магниевые сплавы, которые обладают высокой прочностью и устойчивостью к коррозии.
Роль магния в организмах:
Магний играет важную роль в организмах живых существ, включая человека. Он является необходимым элементом для работы многих ферментов и участвует во множестве биохимических реакций.
Магний также влияет на здоровье костей и зубов, сердечно-сосудистую систему, нервную систему и мышцы. Недостаток магния может привести к различным проблемам, включая мышечные судороги, нарушения сна, ухудшение памяти и концентрации.
Магний – это важный элемент, который играет роль во множестве процессов как в природе, так и в организмах живых существ. Его физические и химические свойства делают его полезным материалом в различных отраслях промышленности, а его роль в организмах делает его важным элементом в поддержании здоровья.
Железо
Железо — химический элемент, который является одним из самых распространенных и важных металлов в мире. Оно имеет атомный номер 26 и химический символ Fe (от латинского слова ferrum).
Железо является ключевым элементом для многих организмов, включая людей. Оно играет важную роль в различных биологических процессах, таких как транспорт кислорода, образование гемоглобина и миоглобина, а также в метаболизме энергии.
Физические свойства железа
Железо является серовато-белым металлом с металлическим блеском. Оно обладает высокой плотностью и твердостью, а также является хорошим проводником электричества и тепла.
При комнатной температуре железо находится в твердом состоянии. Оно обладает магнитными свойствами и является ферромагнетиком. Железо обладает достаточно высокой температурой плавления — около 1538 градусов Цельсия.
Химические свойства железа
Химически железо реагирует с кислородом и образует оксиды. Наиболее известными оксидами железа являются оксид железа(II) (FeO), оксид железа(III) (Fe2O3) и гематит (Fe2O3). Железо также образует соединения с другими элементами, такие как сера, углерод и фосфор.
Железо имеет несколько степеней окисления, включая +2 и +3. Это позволяет ему образовывать различные соединения с разными свойствами и применениями.
Применение железа
Железо имеет широкий спектр применений в различных отраслях промышленности. Оно используется для производства стали, которая является одним из самых важных строительных материалов. Железо также используется для производства различных металлических изделий, машин и оборудования.
Кроме промышленного использования, железо также является важным элементом для здоровья человека. Его необходимость заключается в том, чтобы организм мог правильно функционировать и выполнять свои биологические процессы.

Вода
Вода – это химическое вещество, состоящее из молекул, каждая из которых состоит из двух атомов водорода и одного атома кислорода, соединенных ковалентной связью. Вода является одним из самых распространенных веществ на Земле и играет важную роль во многих биологических процессах.
Физические свойства воды:
- Вода является универсальным растворителем, способным растворять множество различных веществ, благодаря своей полярности и возможности образования водородных связей.
- Вода обладает высокой теплоемкостью, что позволяет ей поглощать и отдавать большое количество тепла без существенного изменения своей температуры.
- Вода имеет высокую поверхностную тензию, что позволяет ей образовывать капли и позволяет растениям транспортировать воду из корней в листья.
- Вода обладает высокой капиллярностью, благодаря которой она может подниматься вверх по тонким трубкам, противодействуя силе тяжести.
Роль воды в биологии:
Вода играет важную роль во многих биологических процессах, таких как фотосинтез, дыхание, гидролиз и многие другие. Она является основным компонентом клеток и тканей организмов и необходима для поддержания жизнедеятельности организмов.
Вода в природе:
Вода находится в различных состояниях в природе, включая жидкое, твердое и газообразное состояния. Около 71% поверхности Земли покрыто водой, большая часть которой находится в океанах и морях. Вода также находится в ледниках, реках, озерах и водных парах в атмосфере.
Вода является одним из основных факторов, обеспечивающих жизнь на Земле. Ее уникальные свойства и ее присутствие во многих биологических процессах делают ее незаменимой для поддержания жизни организмов и функционирования экосистем.
Органические вещества
Органические вещества — это химические соединения, которые содержат углеродные атомы, связанные с водородом и другими элементами. Углерод является основным строительным элементом органических молекул и играет ключевую роль в формировании их структуры и свойств.
Органические вещества имеют широкий спектр свойств и могут быть найдены во многих формах, включая газы (например, метан), жидкости (например, этанол) и твердые вещества (например, глюкоза). Они также могут образовывать полимеры, такие как полиэтилен и полиестер, которые широко используются в промышленности и быту.
Свойства органических веществ
Органические вещества обладают рядом уникальных свойств, которые делают их особенными и важными для жизни на Земле.
- Восприимчивость к химическим реакциям: Углеродные атомы в органических молекулах могут образовывать сильные химические связи с другими элементами, что позволяет им участвовать в различных реакциях.
- Разнообразие структур: Углерод может образовывать множество различных структурных конфигураций и связей, что позволяет органическим молекулам иметь широкий спектр форм и свойств.
- Полярность: Органические молекулы могут быть как поларными, так и неполярными, что влияет на их взаимодействие с другими веществами и их растворимость в различных средах.
- Реакционная активность: Органические вещества могут участвовать во многих химических реакциях, включая синтез новых соединений и разрушение старых, что позволяет им играть важную роль в биологии и химии.
Примеры органических веществ
Органические вещества встречаются повсеместно и могут быть найдены во многих природных и искусственных материалах. Некоторые примеры органических веществ включают:
- Углеводороды: Это класс органических соединений, состоящих только из углерода и водорода. Примеры включают метан, этилен и бензол.
- Аминокислоты: Они являются основными строительными блоками белков и играют важную роль в биологических процессах. Примеры включают аланин, глицин и лейцин.
- Нуклеотиды: Они являются строительными блоками ДНК и РНК и несут генетическую информацию. Примеры включают аденин, цитозин и тимин.
- Липиды: Это класс органических молекул, которые служат структурными компонентами клеток и играют роль в хранении энергии. Примеры включают холестерол, фосфолипиды и триглицериды.
Органические вещества являются основой жизни на Земле и играют важную роль в многих биологических и химических процессах. Изучение органической химии позволяет нам лучше понять и использовать эти уникальные соединения.